chemija
Stechiometrijos įstatymai apibūdina skirtingų medžiagų sudėtį, pagrįstą kiekvienos rūšies, kuri įsijungia į reakciją, santykiais (masės). Visą esamą medžiagą sudaro įvairių cheminių elementų, sudarančių periodinę lentelę, derinimas įvairiomis proporcijomis. Šias sąjungas reglamentuoja tam tikri derinimo įstatymai, vadinami „stechiometrijos įstatymais“ arba „chemijos svorio įstatymais“. Šie principai yra esminė kiekybinės che
Etanamidas yra cheminė medžiaga, priklausanti organinių azoto junginių grupei. Ji taip pat gauna acetamido pavadinimą, pasak Tarptautinės grynosios ir taikomosios chemijos sąjungos (IUPAC už jos akronimą anglų kalba). Komerciniu požiūriu tai vadinama acto rūgšties amidu. Tai vadinama amidu, nes azotas yra prijungtas prie karbonilo grupės. Tai yra pirmi
„ Maillard“ reakcija - tai pavadinimas, suteiktas cheminėms reakcijoms tarp aminorūgščių ir redukuojančių cukrų, kurie užgožia maistą skrudinimo, kepimo, kepimo ir kepimo metu. Rudieji junginiai yra atsakingi už tokių produktų, kaip duonos pluta, skrudinta jautiena, bulvytės ir kepti sausainiai, spalvą ir aromatą. Reakciją skatina ši
Aliuminio chloridas arba aliuminio trichloridas (AlCl3) yra dvejetainė druska, sudaryta iš aliuminio ir chloro. Kartais jis atrodo kaip geltonasis milteliai, nes jis turi priemaišų dėl geležies (III) chlorido. Jis gaunamas derinant jo elementus. Aliuminis, kurio paskutiniame energijos lygmenyje yra trys elektronai (IIIA šeima), yra linkęs jas duoti dėl savo metalo. Chloras
Karboksirūgštis yra terminas, priskiriamas bet kuriam organiniam junginiui, turinčiam karboksilo grupę. Jie taip pat gali būti vadinami organinėmis rūgštimis ir yra daugelyje natūralių šaltinių. Pavyzdžiui, skruzdžių rūgštis, karboksirūgštis, distiliuojama iš skruzdžių ir kitų vabzdžių, tokių kaip vabalas galerita. Tai reiškia, kad smilkal
Alendrono rūgštis yra organinis junginys, priklausantis bisfosfonatų, ypač antrosios kartos, klasifikacijai; Tai yra tie, kuriuose yra azoto atomų. Šis junginys ir kiti bisfosfonatai turi didelę struktūrinę analogiją su neorganiniu pirofosfatu (PPi). Neorganinis pirofosfatas yra daugelio sintetinių reakcijų organizme produktas. Jis yra la
Skruzdžių rūgštis arba metano rūgštis Tai paprasčiausias ir mažiausias organinių rūgščių junginys. Taip pat žinomas kaip metano rūgštis, o jo molekulinė formulė yra HCOOH, turinti tik vieną vandenilio atomą, prijungtą prie anglies atomo. Jo pavadinimas kilęs iš žodžio formica , kuris lotynų kalba reiškia ant. Penkioliktojo amžiaus gam
Vyno rūgštis yra organinis junginys, kurio molekulinė formulė yra COOH (CHOH) 2 COOH. Ji turi dvi karboksilo grupes; tai reiškia, kad jis gali išleisti du protonus (H +). Kitaip tariant, tai yra diprotinė rūgštis. Be to, jis gali būti klasifikuojamas kaip alksnio rūgštis (rūgštinis cukrus) ir gintaro rūgšties darinys. Jo druska žino
Kalcio chloridas (CaCl 2) Tai neorganinė druska, sudaryta iš kalcio, šarminio metalo ir chloro halogeno. Šiame junginyje yra keletas elektrostatinių sąveikų, kurios apibrėžia išorinę jo kristalų išvaizdą ir likusias jų fizines savybes. Be to, ji visada yra kartu su vandens molekulėmis, sudarančiomis bendrojo formulės CaCl2 · xH2O hidratus, kurių x = 0, 1, 2, 4 ir 6. Kai x = 0, druska
Egzoterminė reakcija yra cheminės reakcijos tipas, kuriame vyksta energijos perdavimas, daugiausia šilumos arba šviesos išsiskyrimo forma. Pavadinimas kilęs iš graikų prefikso exo , o tai reiškia „į išorę“; ir terminas „terminis“, kuris reiškia šilumą ar temperatūrą. Šia prasme egzoterminės reakcijos gali perduoti kitokios rūšies energiją į aplinką, kurioje jos yra sukurtos, pvz., Sprogimo būdu ir jų kinetinės
Cheminiai tirpalai chemijoje yra žinomi kaip homogeniniai mišiniai. Jie yra stabilūs dviejų ar daugiau medžiagų mišiniai, kuriuose viena medžiaga (vadinama tirpikliu) ištirpsta į kitą (vadinama tirpikliu). Tirpalai pripildo tirpiklio fazę mišinyje ir gali egzistuoti kietose, skystose ir dujinėse fazėse. Gamtoje yra d
Pirolizę sudaro terminis skilimo procesas, kai didelės daugumos organinės kilmės medžiagos yra veikiamos aukštos temperatūros inertinėje terpėje (be deguonies). Kai organinės medžiagos yra apdorojamos pirolizės būdu, gaunami pramonėje naudojami produktai. Vienas iš elementų, kuriuos galima gauti, yra koksas, kuris naudojamas kaip kuro tipas su pramoninėmis savybėmis. Taip pat galite
Termochemija yra atsakinga už kalorijų modifikacijų, atliekamų reakcijose tarp dviejų ar daugiau rūšių, tyrimą. Tai laikoma esminiu termodinamikos elementu, kuris tiria šilumos ir kitų rūšių energijos transformaciją, kad suprastų procesų vystymosi kryptį ir jų energijos skirtumus. Be to, svarbu suprasti, kad šiluma apima šilumos energijos perdavimą, kuris vyksta tarp dviejų kūnų, kai jie yra skirtingose temperatūrose; o šiluminė energija yra ta, kuri yra susijusi su atsitiktiniu judėjimu, kurį turi atomai ir molekulės. Todėl, kaip ir beveik visose chem
Kalio nitratas yra tretinė druska, sudaryta iš kalio, šarminio metalo ir oksoanio nitrato. Jo cheminė formulė yra KNO 3 , o tai reiškia, kad kiekvienam K + jonui yra NO 3 jonų, kurie su juo sąveikauja. Todėl tai yra joninė druska ir sudaro vieną iš šarminių nitratų (LiNO3, NaNO3, RbNO 3 ...). KNO 3 yra
Difenilaminas yra organinis junginys, kurio cheminė formulė yra (C6H5) 2NH. Jo pavadinimas rodo, kad tai yra aminas, taip pat jo formulė (-NH2). Kita vertus, terminas "difenilas" reiškia dviejų aromatinių žiedų, susietų su azotu, buvimą. Todėl difenilaminas yra aromatinis aminas. Organinių
Stroncio chloridas yra neorganinis junginys, sudarytas iš stroncio, šarminio metalo (p. Becamgbara) ir halogeno chloro. Kadangi abu elementai turi labai skirtingus elektronegatyvumus, junginys yra joninė kieta medžiaga, kurios cheminė formulė yra SrCl2. Kadangi tai yra joninė kieta medžiaga, ją sudaro jonai. SrCl 2
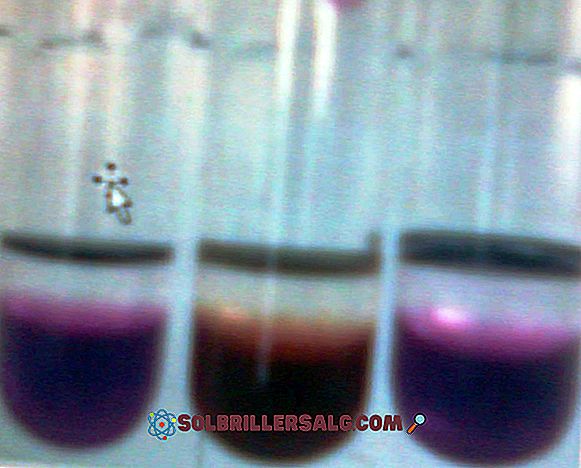
Fenolftaleinas yra organinis dažiklis, kuris savo ruožtu yra silpna diprotinė rūgštis, daugelyje tūrių nustatymų, kaip rūgšties ir bazės indikatorius. Tai yra, jei tai yra diprotinė rūgštis, tirpale ji gali prarasti du H + jonus ir būti rodikliu, kad ji turi būti spalvinga vertinamame pH intervale. Bazinėje terpė
Kalio permanganatas (KMnO 4) yra neorganinis junginys, sudarytas iš mangano - pereinamojo metalo 7 grupės (VIIB) -, deguonies ir kalio. Tai tamsiai violetinė stiklinė kieta medžiaga. Jų vandeniniai tirpalai taip pat yra tamsiai violetiniai; Šie tirpalai tampa mažiau violetiniai, nes jie skiedžiami didesniu vandens kiekiu. Tuomet
Stroncio oksidas , kurio cheminė formulė yra SrO (negali būti painiojama su stroncio peroksidu, kuris yra SrO2), yra oksidacinės reakcijos tarp šio metalo ir ore esančio deguonies, esančios kambario temperatūroje, produktas. O2 (g) → 2SrO (s). Stroncio gabalas susiliečia su oru dėl didelio reaktyvumo, ir kadangi jis turi elektroninę ns2 tipo konfigūraciją, jis lengvai duoda savo dviejų valentinių elektronų, ypač deguonies diatominės molekulės. Jei metalo paviršia
Diferencinis arba diferencijuotas elektronas yra paskutinis elektronas, patalpintas atomo elektroninės konfigūracijos sekoje. Kodėl jo vardas? Norint atsakyti į šį klausimą, būtina pagrindinė atomo struktūra: jos branduolys, vakuumas ir elektronai. Branduolys yra tankus, kompaktiškas teigiamų dalelių, vadinamų protonais, ir neutralių dalelių, vadinamų neutronais, agregatas. Protonai apibrė
Hidroksapatitas yra kalcio fosfato mineralas, kurio cheminė formulė yra Ca 10 (PO 4 ) 6 (OH) 2 . Kartu su kitomis mineralinėmis medžiagomis ir organinėmis medžiagomis išlieka susmulkinta ir suspausta, ji sudaro žaliavą, žinomą kaip fosforo roko. Terminas "hidroksi" reiškia OH-anijoną. Jei vietoj
Magnio fosfatas yra terminas, vartojamas neorganinių junginių šeimai, susidedančiai iš magnio, šarminio metalo ir oksanoiono fosfato. Paprasčiausias magnio fosfatas turi cheminę formulę Mg 3 (PO 4 ) 2 . Formulė rodo, kad kiekvienam dviem anijonams PO 4 3- yra trys Mg2 + katijonai, sąveikauja su jais. Be to, ši
„Pyrex“ stiklas yra specialus borosilikatinis stiklas, kurio prekės ženklas (Pyrex) pasirodė 1915 m. Niujorko mieste, pagamintas „Corning Glass“. Jis tapo modernios maisto pakuotės medžiaga, taip pat naudojamas maisto saugojimui ir kepimui tame pačiame inde. Žodžio „Pyrex“ kilmė sukėlė tam tikrus neatitikimus, tačiau pripažįstama, kad ji yra kilusi iš labiausiai parduodamo gaminio pradinėse komercializacijos akimirkose: plokštė, kurioje kepta pyragas. Su šiuo stiklu daugybė medži
Enantiomerai yra tie organinių (ir neorganinių) junginių poros, kurie susideda iš dviejų veidrodžio vaizdų, kurie negali sutapti vienas su kitu. Priešingu atveju, pavyzdžiui, kamuolys, golfo klubas ar šakutė - jie yra chirurginiai objektai. Terminą chiralumas sukūrė William Thomson (Viešpats Kelvinas), kuris nustatė, kad objektas yra chiralinis, jei jis negali sutapti su savo veidrodžio vaizdu. Pavyzdžiui, ran
Spalvotieji metalai yra visi tie, kurie neturi arba turi nedidelį kiekį geležies. Šie skirtingų masių santykiai naudojami lydiniams, turintiems geresnes fizines savybes nei atskiriems metalams. Taigi jo kristalinės struktūros ir metalinės sąveikos yra spalvotųjų metalų lydinių taikymo kertinis akmuo. Tačiau šie g
Krituliai arba cheminis nusodinimas - tai procesas, kurio metu susidaro netirpi kietoji medžiaga iš dviejų homogeninių tirpalų mišinio. Skirtingai nuo lietaus ir sniego nusodinimo, šio tipo krituliuose „nuo lietaus“ lieka kietas. Dviejuose homogeniniuose tirpaluose jonai ištirpinami vandenyje. Kai jie są
Periodinės lentelės elementų metalo pobūdis reiškia visus cheminius ir fizinius kintamuosius, kurie apibrėžia metalus arba atskiria juos nuo kitų gamtos medžiagų. Paprastai jos yra ryškios, tankios, kietos kietos medžiagos, turinčios didelį šiluminį ir elektrinį laidumą, formuojamą ir kaliojo. Tačiau ne visi me
Diazono druskos yra organiniai junginiai, kuriuose yra azo grupės (-N2 +) ir anijono X- (Cl-, F-, CH3COO-) jonų sąveikos. Jo bendra cheminė formulė yra RN2 + X-, ir šitoje šoninėje grandinėje R gali būti alifatinė grupė arba arilo grupė; tai yra aromatinis žiedas. Žemiau esančiame vaizde yra rodoma arenodiazonio jonų struktūra. Mėlynos spalvos
Juodieji metalai yra geležies (Fe) turintys metalai , taip pat nedideli kitų metalų kiekiai, kurie yra naudojami tam tikroms naudingoms savoms lydiniams. Nors geležis gali egzistuoti įvairiose oksidacijos būsenose, dažniausiai pasitaiko +2 (geležies) ir +3 (geležies). Tačiau terminas „geležies“ reiškia geležies buvimą, nepaisant jo oksidacijos būsenos medžiagoje. Geležis yra ketvir
Juostos teorija yra ta, kuri apibrėžia visos kietosios medžiagos elektroninę struktūrą. Jis gali būti taikomas bet kokio tipo kietosioms medžiagoms, bet jis yra metalų, kuriuose atsispindi didžiausios sėkmės. Pagal šią teoriją metalo jungtis atsiranda dėl elektrostatinio traukimo tarp teigiamai įkrautų jonų ir mobiliųjų elektronų kristale. Todėl metalinis kris