Periodinė elementų lentelė: istorija, struktūra, elementai
Periodinė elementų lentelė yra įrankis, leidžiantis susipažinti su iki šiol žinomų 118 elementų cheminėmis savybėmis. Svarbu, kai atliekami stechiometriniai skaičiavimai, numatyti elemento fizines savybes, juos klasifikuoti ir periodiškai surasti visas jų savybes.
Atomai tampa sunkesni, nes jų branduoliai prideda protonų ir neutronų, kuriuos taip pat turi lydėti nauji elektronai; priešingu atveju elektroneutralumas nebūtų įmanoma. Taigi kai kurie atomai yra labai lengvi, kaip ir vandenilis, ir kiti, labai sunkūs, kaip ir oganesonas.

Kas yra skolinga tokioms širdims chemijoje? Mokslininkui Dmitrijui Mendeléjevui, kuris 1869 m. (Beveik prieš 150 metų) po dešimtmečio teorinių studijų ir eksperimentų paskelbė pirmąją periodinę lentelę, siekdamas organizuoti tuo metu žinomus 62 elementus.
Tam Mendeléyev buvo pagrįstas cheminėmis savybėmis, tuo pačiu metu Lothar Meyer paskelbė kitą periodinę lentelę, kuri buvo organizuota pagal elementų fizines savybes.
Iš pradžių lentelėje buvo „tuščių erdvių“, kurių elementai šiais metais nebuvo žinomi. Tačiau Mendeléjevas galėjo tiksliai nuspėti keletą jo savybių. Kai kurie iš šių elementų buvo: germanis (kurį vadino eka-siliciu) ir gallium (eka-aliuminis).
Pirmosios periodinės lentelės užsakė elementus pagal jų atomines mases. Šis susitarimas leido pažvelgti į tam tikrą periodiškumą (kartojimą ir panašumą) elementų cheminėse savybėse; nepaisant to, pereinamojo laikotarpio elementai nesutiko su šia tvarka ir tauriųjų dujų.
Dėl šios priežasties reikėjo užsakyti elementus, atsižvelgiant į atominį skaičių (protonų skaičių), o ne į atominę masę. Iš čia, kartu su sunkiu darbu ir daugelio autorių įnašais, Mendeléjevo periodinė lentelė buvo tobulinama ir baigta.
Periodinės lentelės istorija
Elementai
Nuo senovės buvo naudojami elementai, kuriais remiantis apibūdinama aplinka (tiksliau - gamta). Tačiau tuo metu jie buvo vadinami materialiuoju etapu ir būsenomis, o ne būdais, kuriais remiamasi viduramžiais.
Senovės graikai turėjo tikėjimą, kad planetą, kurioje gyvenome, sudarė keturi pagrindiniai elementai: „Fier“, „ti erra“, „gua“ ir „aire“.

Kita vertus, senovės Kinijoje elementų skaičius buvo penki ir, skirtingai nei graikai, jie išskyrė orą ir įtraukė metalą ir medieną.

Pirmąjį mokslinį atradimą 1669 m. Atliko Vokietijos Henning Brandas, kuris atrado fosforą; nuo tos datos buvo įrašyti visi tolesni elementai.

Verta paminėti, kad kai kurie elementai, pvz., Auksas ir varis, jau buvo žinomi prieš fosforą; skirtumas yra tas, kad jie niekada nebuvo užregistruoti.
Simbologija
Alchemikai (dabartinių chemikų pirmtakai) pavadino elementus, susijusius su žvaigždynais, jų atradėjais ir vietomis, kur jie buvo atrasti.
1808 m. Daltonas pasiūlė keletą brėžinių (simbolių), kurie atspindėtų elementus. Tuomet ši žymėjimo sistema buvo pakeista Jono Berzeliaus (naudojama iki šios datos) sistema, nes Daltono modelis tapo sudėtingesnis, kai atsirado naujų elementų.
Schemos raida
Pirmieji bandymai sukurti žemėlapį, organizuojantį cheminių elementų informaciją, įvyko XIX a. Su Döbereiner triadu (1817).

Per metus buvo rasta naujų elementų, dėl kurių atsirado naujų organizacinių modelių, kol pasiekiamas šiuo metu naudojamas modelis.
„Chancurtois telluric“ varžtas (1862)
Alexandré-Émile Béguyer de Chancourtois sukūrė popieriaus spiralę, kurioje parodė spiralinį grafiką (tellūrinis varžtas).
Šioje sistemoje elementai yra užsakomi vis dažniau, atsižvelgiant į jų atominius svorius. Panašūs elementai yra suderinti vertikaliai.
Okeanijos (1865 m.)
Tęsdamas Döbereinerio darbą, britų Johno Aleksandro karalienės Newlands užsakė cheminius elementus didėjančia tvarka dėl atomo svorio, pažymėdama, kad kas septyni elementai turi savybių panašumus (vandenilis nėra įtrauktas).
Mendeléyvo lentelė (1869 m.)
Mendeléyv užsakė cheminius elementus didėjančia tvarka pagal atomo svorį, į tą pačią stulpelį įdėjus tuos, kurių savybės buvo panašios. Per savo periodinės lentelės modelio tuščiavidurius elementus numatoma, kad ateityje atsiras naujų elementų (be to, numatomos turimos savybės).
Nendrinės dujos nėra įtrauktos į Mendeléyvo stalą, nes jos dar nebuvo aptiktos. Be to, Mendeléiv nemanė vandenilio.
Moseley periodinė lentelė (dabartinė periodinė lentelė) - 1913 m
Henry Gwyn Jeffreys Moseley pasiūlė užsakyti periodinio stalo cheminius elementus pagal jų atominį skaičių; tai yra, atsižvelgiant į jų protonų skaičių.
Moseley 1913 m. Paskelbė „Periodinę teisę“: „Kai elementai išdėstomi pagal jų atominius numerius, jų fizinės ir cheminės savybės rodo periodines tendencijas“.
Taigi kiekviena horizontali eilutė arba laikotarpis rodo santykio tipą, o kiekviena stulpelis arba grupė rodo kitą.
Kaip tai organizuojama? (Struktūra ir organizavimas)

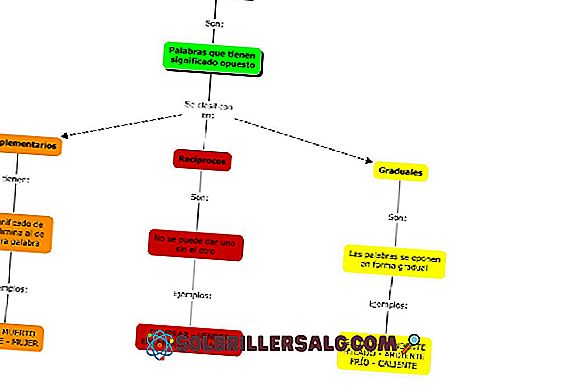
Galima pastebėti, kad periodinio stalo pyragas turi keletą spalvų. Kiekviena spalva susieja elementus su panašiomis cheminėmis savybėmis. Yra oranžinės, geltonos, mėlynos, violetinės kolonos; žalios spalvos kvadratų ir žalios obuolio įstrižainės.
Atkreipkite dėmesį, kad vidurinių stulpelių kvadratai yra pilkos spalvos, todėl visi šie elementai turi turėti kažką bendro, ty jie yra pereinamieji metalai su pusiau pilnais orbitais.
Panašiai violetinių kvadratų elementai, nors ir eina iš dujinių medžiagų, iš rausvos skysčio ir net kietos juodos (jodo) ir sidabro pilkos spalvos (astatino), yra jų cheminės savybės, dėl kurių jie tampa panašūs. Šias savybes reguliuoja jų atomų elektroninės struktūros.
Periodinės lentelės organizavimas ir struktūra nėra savavališki, tačiau laikosi periodiškų elementų serijos savybių ir modelių. Pavyzdžiui, jei metalinis ženklas sumažėja iš kairės į dešinę nuo stalo, viršutiniame dešiniajame kampe negalima tikėtis metalinio elemento.
Laikotarpiai
Elementai išdėstomi eilėmis arba laikotarpiais, priklausomai nuo jų orbitų energijos lygio. Iki 4-ojo laikotarpio, kai elementams pavyko padidinti atominės masės eilę, nustatyta, kad kiekvienos aštuonios jų cheminės savybės buvo pakartotos (oktavų įstatymas, John Newlands).
Pereinamieji metalai buvo įterpti į kitus nemetalinius elementus, pvz., Sierą ir fosforą. Dėl šios priežasties kvantinės fizikos ir elektroninių konfigūracijų įėjimas į šiuolaikinių periodinių stalų supratimą buvo gyvybiškai svarbus.
Energinio sluoksnio orbitos užpildytos elektronais (ir protonų ir neutronų branduoliais), nes jis juda per laikotarpį. Šis energingas sluoksnis eina kartu su dydžiu arba atominiu spinduliu; todėl aukštesnių laikotarpių elementai yra mažesni nei žemiau.
H ir Jis yra pirmame (periodiniame) energijos lygmenyje; pirmoji pilkų kvadratų eilutė, ketvirtuoju laikotarpiu; ir apelsinų kvadratų eilutė, šeštąjį laikotarpį. Atkreipkite dėmesį, kad nors pastarasis atrodo tariamu devintuoju laikotarpiu, jis iš tikrųjų priklauso šeštajai, tik po to, kai geltonas kvadratas Ba.
Grupės
Per laikotarpį mes matome, kad didėja masė, protonų ir elektronų skaičius. Toje pačioje skiltyje arba grupėje, nors masė ir protonai skiriasi, elektronų skaičius valentiniame korpuse yra tas pats.
Pavyzdžiui, pirmame stulpelyje arba grupėje H turi vieną elektroną 1s1 orbitoje, kaip ir Li (2s1), natrio (3s1), kalio (4s1) ir pan. Šis skaičius 1 reiškia, kad šie elementai vos turi valentinio elektrono ir todėl priklauso 1 grupei (IA). Kiekvienas elementas yra skirtingais laikotarpiais.
Neskaitant vandenilio, žaliosios dėžutės, žemiau esantys elementai yra oranžinės dėžės ir vadinami šarminiais metalais. Dar vienas langelis dešinėje bet kuriuo laikotarpiu yra grupė arba 2 stulpelis; tai yra, jo elementai turi du valentinius elektronus.
Tačiau judant vienu žingsniu toliau į dešinę, be žinios apie orbitales, jūs pateksite į boro grupę (B) arba 13 grupę (IIIA); vietoj 3 grupės (IIIB) arba skandžio (Sc). Atsižvelgiant į d orbitų užpildymą, pilkųjų kvadratų laikotarpiai prasideda: pereinamieji metalai.
Protonų ir valentinių elektronų skaičius
Tiriant periodinę lentelę, gali atsirasti painiava tarp atominio skaičiaus Z arba viso branduolio protonų skaičiaus ir valentinių elektronų kiekio. Pavyzdžiui, anglis turi Z = 6, ty ji turi šešis protonus ir todėl šešis elektronus (kitaip jis negali būti atomas su neutraliu krūviu).
Tačiau iš šių šešių elektronų keturi yra valentai . Dėl šios priežasties jos elektroninė konfigūracija yra [He] 2s22p2. [Jis] reiškia du uždarojo sluoksnio elektronus 1s2 ir teoriškai jie nedalyvauja cheminių ryšių formavime.
Taip pat, kadangi anglis turi keturis valentų elektronus, "patogiai" yra periodinės lentelės 14 grupėje (IVA).
Žemiau anglies (Si, Ge, Sn, Pb ir Fl) esantys elementai turi didesnius atomų skaičius (ir atominės masės); bet visi turi bendrą keturių valentų elektronų. Tai yra esminis dalykas siekiant suprasti, kodėl vienas elementas priklauso vienai grupei, o ne kitai.
Periodinės lentelės elementai
Blokas s
Kaip paaiškinta, 1 ir 2 grupėms būdingas vienas ar du elektronai orbitose. Šios orbitos yra sferinės geometrijos, o nusileidus per bet kurią iš šių grupių, elementai įgyja sluoksnius, kurie padidina jų atomų dydį.
Pateikdami stiprias jų cheminių savybių ir reagavimo būdų tendencijas, šie elementai yra organizuojami kaip blokas. Todėl šiam blokui priklauso šarminiai metalai ir šarminiai metalai. Šio bloko elementų elektroninė konfigūracija yra ns (1s, 2s ir tt).
Nors helio elementas yra viršutiniame dešiniajame stalo kampe, jo elektroninė konfigūracija yra 1s2 ir todėl priklauso šiam blokui.
Blokas p
Skirtingai nuo blokų, šio bloko elementai visiškai užpildo orbitą, o jų p-orbitos ir toliau užpildo elektronais. Šiam blokui priklausančių elementų elektroninės konfigūracijos yra ns2np1-6 tipo (p orbitoje gali būti vienas arba šeši elektronai užpildyti).
Taigi, kokia periodinės lentelės dalis yra šis blokas? Dešinėje: žalia, violetinė ir mėlyna kvadratai; tai yra nemetaliniai elementai ir sunkieji metalai, tokie kaip bismutas (Bi) ir švinas (Pb).
Pradedant nuo boro su elektronine konfigūracija ns2np1, jo dešinėje esanti anglis prideda kitą elektroną: 2s22p2. Toliau kitų bloko p 2 periodo elementų elektroninės konfigūracijos yra: 2s22p3 (azotas), 2s22p4 (deguonis), 2s22p5 (fluoras) ir 2s22p6 (neonas).
Jei einate į žemesnius laikotarpius, turėsite energijos lygį 3: 3s23p1-6 ir pan. Iki bloko pabaigos.
Atkreipkite dėmesį, kad svarbiausias dalykas šiuo bloku yra tas, kad nuo 4-ojo laikotarpio jos elementai yra visiškai užpildyti orbitomis (mėlynos dėžės dešinėje). Apibendrinant: blokas s yra periodinės lentelės kairėje ir blokas p dešinėje.
Atstovaujamieji elementai
Kokie yra tipiniai elementai? Jie yra tie, kurie, viena vertus, lengvai praranda elektronus, arba, kita vertus, įgyja juos užbaigti valentų oktetą. Kitaip tariant, jie yra blokų s ir p elementai.
Jų grupės buvo išsiskiriančios iš kitų A raidės pabaigoje. Taigi buvo aštuonios grupės: nuo IA iki VIIIA. Tačiau šiuo metu šiuolaikinėse periodinėse lentelėse naudojama numeravimo sistema yra arabų, nuo 1 iki 18, įskaitant pereinamuosius metalus.
Dėl šios priežasties boro grupė gali būti IIIA arba 13 (3 + 10); anglies grupė, PVM arba 14; ir tauriųjų dujų, paskutinė dešinėje pusėje - VIIIA arba 18.
Pereinamieji metalai
Pereinamieji metalai yra visi pilkųjų kvadratų elementai. Per visą jų laikotarpį jie užpildo savo orbitales d, kurios yra penkios ir todėl gali turėti dešimt elektronų. Kadangi jie turi turėti dešimt elektronų tokiems orbitams užpildyti, tada turi būti dešimt grupių ar stulpelių.
Kiekviena iš šių grupių senojoje numeravimo sistemoje buvo pažymėta romėniškais skaitmenimis ir raidė B pabaigoje. Pirmoji grupė - skandiumas - buvo IIIB (3), geležies, kobalto ir nikelio VIIIB, turinčių labai panašius reaktyvumus (8, 9 ir 10) ir cinko IIB (12).
Kaip matyti, daug lengviau atpažinti grupes pagal arabiškus skaičius nei naudojant romėniškus skaitmenis.
Vidiniai pereinamieji metalai
Per periodinės lentelės 6 laikotarpį f orbitos pradeda būti energingai prieinamos. Pirmiausia jie turi būti užpildyti nei d orbitos; todėl jos elementai paprastai yra atskirti, kad nebūtų pernelyg ilginamas stalas.
Paskutiniai du laikotarpiai - oranžiniai ir pilki - yra vidiniai pereinamieji metalai, dar vadinami lantanidais (retaisiais žemėmis) ir aktinidais. Yra septynios orbitalijos, kurioms reikia keturiolika elektronų, todėl turi būti keturiolika grupių.
Jei šios grupės bus įtrauktos į periodinę lentelę, iš viso bus 32 (18 + 14) ir bus „pailgos“ versijos:

Šviesiai rožinė eilutė atitinka lantanoidus, o tamsiai rožinė eilutė atitinka aktinoidus. Lantanas, La su Z = 57, aktinas, Ac su Z = 89, ir visas blokas f priklauso tai pačiai skandžio grupei. Kodėl? Kadangi skandiumas turi nd1 orbitą, kuris yra lantanoiduose ir aktinoiduose.
La ir Ac turi valentų konfigūracijas 5d16s2 ir 6d17s2. Perkeliant į dešinę per abi eilutes, 4f ir 5f orbitos pradeda užpildyti. Kai tik užpildysite, jūs pasiekiate elementus Lutecio, Lu ir laurencio, Lr.
Metalai ir nemetalai
Paliekant už periodinio stalo pyragą, patogiau kreiptis į viršutinį vaizdą, net ir pailgos formos. Šiuo metu dauguma minėtų elementų yra metalai.
Kambario temperatūroje visi metalai yra kietos medžiagos (išskyrus gyvsidabrį, kuris yra skystas) pilkai sidabru (išskyrus varį ir auksą). Be to, jie paprastai yra sunkūs ir ryškūs; nors tie, kurie yra bloke, yra minkšti ir trapūs. Šiems elementams būdingas sugebėjimas prarasti elektronus ir sudaryti M + katijonus.
Lantanoidų atveju jie praranda tris 5d16s2 elektronus, kad jie taptų trivalentiais M3 + katijonais (pvz., La3 +). Ceriumas, kita vertus, gali prarasti keturis elektronus (Ce4 +).
Kita vertus, ne metaliniai elementai sudaro mažiausią periodinės lentelės dalį. Tai yra dujos arba kietosios medžiagos, turinčios kovalentiškai sujungtų atomų (pvz., Sieros ir fosforo). Visi yra bloke p; tiksliau, viršutinėje pastarosios dalyje, mažėjant žemesniems laikotarpiams, didėja metalo pobūdis (Bi, Pb, Po).
Be to, ne metalai, o ne prarasti elektronai, laimi juos. Taigi jie sudaro X-anijonus su skirtingais neigiamais krūviais: -1 halogenams (17 grupė) ir -2 chalkogenams (16 grupė, deguonies grupei).
Metalinės šeimos
Metalų viduje yra vidinė klasifikacija, skirta atskirti:
- 1 grupės metalai yra šarminiai
-Grupė 2, šarminiai metalai (p. Becambara)
-Group 3 (IIIB) „Scandium“ šeima. Šią šeimą atitinka skandis, grupės galva, itrio Y, lantano, aktino ir visų lantanoidų ir aktinoidų.
- 4 grupė (IVB), titano šeima: Ti, Zr (cirkonis), Hf (hafnium) ir Rf (rutherfordio). Kiek valentų elektronų jie turi? Atsakymas yra jūsų grupėje.
- 5 grupė (VB), vanadžio šeima. 6 grupė (VIB), chromo šeima. Ir taip toliau, kol cinko šeima, 12 grupė (IIB).
Metaloidai
Metalinis simbolis didėja iš dešinės į kairę ir iš viršaus į apačią. Bet kokia yra šių dviejų cheminių elementų rūšių riba? Ši siena susideda iš elementų, vadinamų metaloidais, kurie pasižymi metalų ir nemetalų savybėmis.
Metaloidai gali būti matomi periodinėje lentelėje „laiptinėje“, prasidedančioje boru, ir baigiasi radioaktyviuoju elementu. Šie elementai yra:
-B: boras
-Silicio: Taip
-Ge: germanium
-As: arsenas
-Sb: antimonas
-Te: Tellūras
-Taip: astatine
Kiekviename iš šių septynių elementų yra tarpinių savybių, kurios skiriasi priklausomai nuo cheminės aplinkos arba temperatūros. Viena iš šių savybių yra puslaidininkystė, ty metaloidai yra puslaidininkiai.
Dujos
Sausumos sąlygomis dujiniai elementai yra ne lengvi metalai, pvz., Azotas, deguonis ir fluoras. Be to, į šią klasifikaciją įtraukta chloro, vandenilio ir tauriųjų dujų. Iš visų jų labiausiai simbolizuoja kilnias dujas, nes jų mažai linkę reaguoti ir elgtis kaip laisvi atomai.
Pastarasis yra periodinės lentelės 18 grupėje ir yra:
-Helio, Jis
-Neonas, Ne
-Argonas, Ar
-krypton, Kr
-Xenonas, Xe
-Radón, Rn
- Ir naujausias iš sintetinių tauriųjų dujų ogannesono, Og.
Visos tauriosios dujos turi bendrą valentinę konfigūraciją ns2np6; tai yra, jie baigė valentų oktetą.
Elementų agregacijos kitose temperatūrose
Elementai yra kietoje, skystoje arba dujinėje būsenoje, priklausomai nuo temperatūros ir jų sąveikos stiprumo. Jei Žemės temperatūra atvės, kol pasieks absoliučią nulį (0K), visi elementai užšaldytų; išskyrus heliumą, kuris kondensuotų.
Šioje ekstremalioje temperatūroje likusios dujos būtų ledo pavidalo.
Kitoje ekstremalioje situacijoje, jei temperatūra būtų apie 6000K, elementai „visi“ būtų dujinės būsenos. Esant tokioms sąlygoms, gali būti pažodžiui pastebimi aukso, sidabro, švino ir kitų metalų debesys.
Naudojimas ir taikymas
Vien tik periodinė lentelė visada buvo ir bus priemonė, skirta konsultuoti simbolių, atominių masių, struktūrų ir kitų elementų savybes. Tai labai naudinga atliekant stechiometrinius skaičiavimus, kurie yra dienos tvarka daugelyje užduočių laboratorijoje ir už jos ribų.
Ne tik tai, bet ir periodinė lentelė leidžia palyginti tos pačios grupės ar laikotarpio elementus. Taigi galima prognozuoti, kaip bus tam tikri elementų junginiai.
Oksidų formulių prognozavimas
Pavyzdžiui, dėl šarminių metalų oksidų, turint vieną valentinį elektroną, taigi ir +1 valentą, tikimasi, kad jų oksidų formulė yra M 2 O tipo. vandenilio, vandens, H2O . Taip pat su natrio, Na2O ir kalio oksidais, K 2 O.
Kitoms grupėms jų oksidai turi turėti bendrą formulę M 2 O n, kur n yra lygus grupės numeriui (jei elementas yra iš bloko, apskaičiuojamas n-10). Taigi anglis, priklausanti 14 grupei, sudaro CO 2 (C 2 O 4/2 ); sieros, 16 grupė, SO3 (S 2 O 6/2 ); ir azoto, 15 grupės, N 2 O 5 .
Tačiau tai netaikoma pereinamiesiems metalams. Taip yra todėl, kad nors geležis priklauso 8 grupei, ji negali prarasti 8 elektronų, bet 2 ar 3. Todėl, užuot įsimindavę formules, svarbiau yra atsižvelgti į kiekvieno elemento valentus.
Valensijos elementai
Periodinės lentelės (kai kurios) rodo galimus kiekvieno elemento valentus. Žinodami šiuos dalykus, galima iš anksto įvertinti junginio nomenklatūrą ir jos cheminę formulę. Kaip minėta, valentai yra susiję su grupės numeriu; nors ji netaikoma visoms grupėms.
Valentai labiau priklauso nuo elektroninių atomų struktūros ir kokie elektronai gali iš tikrųjų prarasti ar laimėti.
Žinodami valentinių elektronų skaičių, taip pat galima pradėti nuo šios informacijos junginio Lewis struktūros. Todėl periodinė lentelė leidžia studentams ir specialistams brėžti struktūras ir atlikti galimų geometrijų ir molekulinių struktūrų tyrimą.
Periodinės skaitmeninės lentelės
Šiandien technologija leido periodines lenteles tapti universalesnėmis ir suteikti daugiau informacijos visiems. Keletas iš jų pateikia ryškias kiekvieno elemento iliustracijas, taip pat trumpą pagrindinių jų naudojimo būdų santrauką.
Tai, kaip ji bendrauja su jais, pagreitina jų supratimą ir mokymąsi. Periodinis stalas turi būti akis malonus įrankis, kurį lengva ištirti, o efektyviausias būdas žinoti jo cheminius elementus - važiuoti iš periodų į grupes.
Periodinės lentelės svarba
Šiuo metu periodinė lentelė yra svarbiausias chemijos organizacinis instrumentas dėl detalių jos elementų santykių. Jo naudojimas yra labai svarbus studentams ir mokytojams, taip pat tyrėjams ir daugeliui specialistų, užsiimančių chemijos ir inžinerijos srityje.
Pažvelkite į periodinę lentelę, greitai ir efektyviai gausite didžiulę sumą ir informaciją, pavyzdžiui:
- Ličio (Li), berilio (Be) ir boro (B) elektra.
- Ličio yra šarminis metalas, berilis yra šarminis metalas, o boras - ne metalas.
- Ličio yra geriausias trijų pavadinimų dirigentas, po to - berilis ir galiausiai boras (puslaidininkis).
Taigi, nustatydami šiuos elementus periodinėje lentelėje, galite iš karto nustatyti jų tendenciją į elektros laidumą.